Los ácidos nucleicos son macromoléculas, polímeros formados por la repetición de monómeros llamados nucleótidos.
Estos tienen al menos dos funciones: trasmitir las características hereditarias de una generación a la siguiente y dirigir la síntesis de proteínas específicas.
Tanto la molécula de ARN como la molécula de ADN tienen una estructura de forma helicoidal.
Químicamente, estos ácidos están formados, como dijimos, por unidades llamadas nucleótidos: cada nucleótido a su vez, está formado por tres tipos de compuestos:
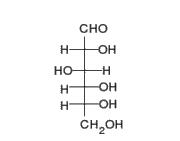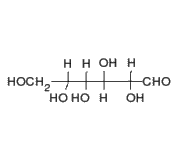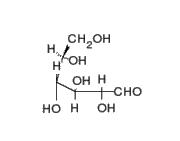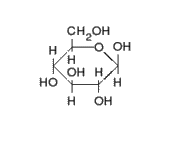
1) Una pentosa o azúcar de cinco carbonos: se conocen dos tipos de pentosas que forman parte de los nucleótidos, la ribosa y la desoxirribosa.
2) Una base nitrogenada: que son compuestos anillados que contienen nitrógeno. Se pueden identificar cinco de ellas: adenina, guanina, citosina, uracilo y timina.
3)Un radical fosfato:

MAPA CONCEPTUAL
TEMA ASOCIADO:
INGENIERIA GENETICA: Método que modifica las características hereditarias de un organismo en un sentido predeterminado mediante la alteración de su material genético. Suele utilizarse para conseguir que determinados microorganismos como bacterias o virus, aumenten la síntesis de compuestos, formen compuestos nuevos, o se adapten a medios diferentes. Otras aplicaciones de esta técnica, también denominada técnica de ADN recombinante, incluye la terapia génica, la aportación de un gen funcionante a una persona que sufre una anomalía genética o que padece enfermedades como síndrome de inmunodeficiencia adquirida (SIDA) o cáncer.
La ingeniería genética consiste en la manipulación del ácido desoxirribonucleico, o ADN. En este proceso son muy importantes las llamadas enzimas de restricción producidas por varias especies bacterianas. Las enzimas de restricción son capaces de reconocer una secuencia determinada de la cadena de unidades químicas (bases de nucleótidos) que forman la molécula de ADN, y romperla en dicha localización. Los fragmentos de ADN así obtenidos se pueden unir utilizando otras enzimas llamadas ligasas. Por lo tanto, las enzimas de restricción y las ligasas permiten romper y reunir de nuevo los fragmentos de ADN. También son importantes en la manipulación del ADN los llamados vectores, partes de ADN que se pueden auto replicar (generar copias de ellos mismos) con independencia del ADN de la célula huésped donde crecen. Estos vectores permiten obtener múltiples copias de un fragmento específico de ADN, lo que hace de ellos un recurso útil para producir cantidades suficientes de material con el que trabajar. El proceso de transformación de un fragmento de ADN en un vector se denomina clonación, ya que se producen copias múltiples de un fragmento específico de ADN. Otra forma de obtener muchas copias idénticas de una parte determinada de ADN es la reacción en cadena de la polimerasa, de reciente descubrimiento. Este método es rápido y evita la clonación de ADN en un vector.
BIBLIOGRAFIA
-Wikipedia, Ácido nucleico [ en linea ]
http://es.wikipedia.org/wiki/%C3%81cido_nucleico [ citado el 26 de septiembre de 2010 ].
-The University Of Arizona, Ácidos nucleicos [ en linea ]
http://superfund.pharmacy.arizona.edu/toxamb/c1-1-1-3.html [ citado en 26 de septiembre de 2010].
-Profesor en linea, Áciso nucleicos [ en linea ]
http://www.profesorenlinea.cl/Ciencias/AcidosNucleicos.htm [ citado en 26 de septiembre de 2010].