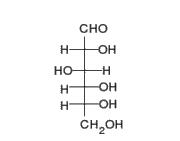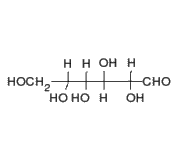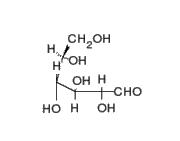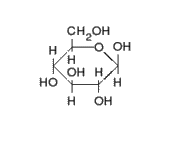
La señalizacion celular es el conjunto de procesos o etapas que ocurren entre la interaccion directa de una celula y su celula siguente o a distancia, que se da de forma consecutiva y es por el cual una célula convierte una determinada señal o estímulo del exterior, en otra señal o respuesta específica que como fin en ocasiones tendria la expresion de un gen al translocarse al nucleo.
Segun la distancia recorrida por la molecula señalizadora, existen tres tipos diferentes de llevar esa señal mediante moleculas secretadas y son:
SEÑALIZACIÓN ENDOCRINA: Las moleculas que se encargan de la señalización son secretadas por células del sistema endocrino y se transportan a traves del torrente sanguíneo hasta alcanzar hasta alcanzar la celula blanca o diana donde estan destinadas a actuar que se encuentran en lugares lejanos del organismo, la respuesta de este mecanismo es lenta pero de larga duracion.
SENALIZACIÓN PARACRINA: A diferencia de la señalización endocrina, la paracrina actua sobre las celulas dianas directamente proximas o vecinas, un ejemplo clara de esta es la que desempeñan los neurotransmisores en el proceso de sinapsis.
SEÑALIZACIÓN AUTOCRINA: Es aquella señalizacion que solo afecta a las células que son del mismo tipo celular, un ejemplo claro de este tipo de señal es la del sistema inmune.
BIBLIOGRAFIA:
-BIOCANCER, Señalización celular básica [ En linea ]
-http://www.biocancer.com/journal/206/senalizacion-celular-basica- [ Citado el 31 de octubre de 2010 ].
-Geoffrey M. Cooper, Robert E. Hausman, LA CELULA, señalizacion celular. quinta edicion-editorial Marbán. 2010. paginas 603 - 644
PROPUESTA: La forma a mi modo de ver para entender, inteorizar y aplicar este tema podría ser un crucigrama ya que después de realizar una primera lectura quedarían términos claves entendidos y se podría colocar en practica por medio del crucigrama donde se nos dieran cortas definiciones de estas palabras para abarcar a totalidad las posibles dudas debido a las semejanzas entre los términos además de ser una forma ludica y pedagogica para el estudio y la memoria.
CRUCIGRAMA ''SEÑALIZACIÓN CELULAR''
PALABRAS:
1.Proceso que ocurre entre dos celulas, donde se produce una señal y una respuesta.
2.La señal la comienza el.....
3.El proceso final de la señalizacion es la .....
4.Donde se realiza la expresiòn del gen como una de las formas en las que puede terminar la señal.
5.La señalizacion donde las moleculas se transportan por la sangre, es la señalización......
6.Un ejemplo claro de la señalización paracrina es la......
7.El primer encargado de resibir la señal es el ......
8.El tipo de señal que ocurre en el sistema inmune es la señalización.....